5.1 Rapidez de reacción
Cinética química
Es el nombre de una especialidad dentro del ámbito de la química física que hace foco en el estudio de la velocidad de reacción. Su propósito es establecer, de manera experimental, qué tan rápido sucede una determinada reacción química y cómo influyen sobre ella el efecto de temperatura y cuestiones vinculadas a un catalizador, al mecanismo de reacción y a la concentración,
¿Qué se entiende por velocidad de reacción?
La velocidad de reacción se define como la cantidad de reactivos que se transforma o producto que se forma por unidad de tiempo. La unidad es molaridad/segundos (M / s).
Existen múltiples factores (como la naturaleza de cada reacción y el efecto de presión) que condicionan a dicha velocidad.
Estos factores son:
A mayor temperatura, mayor velocidad de reacción.
El sentido del flujo de energía entre los miembros de la reacción, determina si esta es exotérmica o endotérmica.
TEMPERATURA
A mayor superficie de contacto, mayor velocidad de reacción. La superficie de contacto determina el número de átomos y moléculas disponibles para la reacción.
SUPERFICIE DE CONTACTO
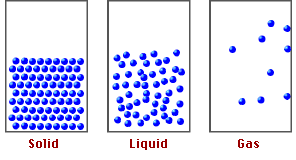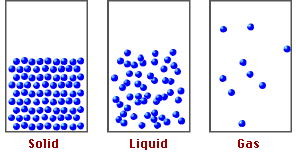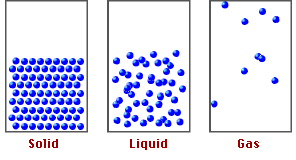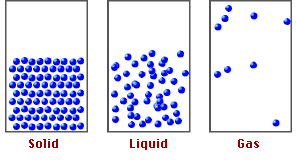
Estado en el que se encuentra la materia y depende de sus características físicas y químicas.
ESTADO DE AGREGACIÓN
A mayor concentración, (mayor presencia de moléculas por unidad de volumen), mayor velocidad de reacción de uno de los reactivos.
CONCENTRACIÓN


Te invitamos a ver
este breve video

Te invitamos a ver este
breve video
Teoría de las reacciones químicas
Las teorías de las reacciones químicas son explicaciones sistemáticas que buscan comprender cómo y por qué ocurren las reacciones químicas. Establecen los principios y mecanismos que explican cómo las sustancias se transforman en otras.
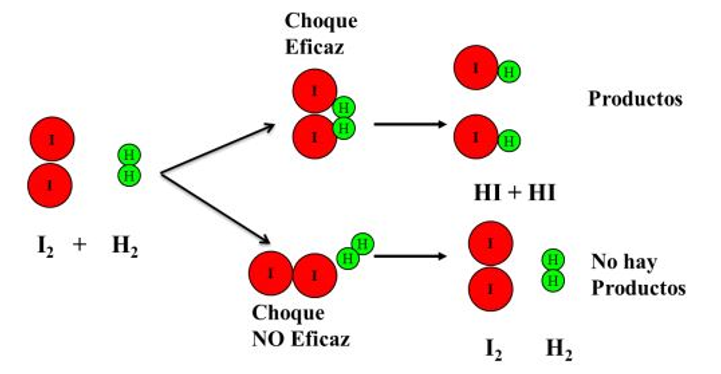
Teoría de las Colisiones
Esta teoría fue propuesta por Max Trautz y Glbert Lewis, y nos indica que para que una reacción ocurra se deben cumplir algunas condiciones mínimas considerando un choque efectivo entre las partículas o moléculas.
Para que los choques sean efectivos deben:
1.
Chocar con la energía suficiente para lograr romper los enlaces de los reactivos y así pueda ocurrir un reordenamiento de los átomos.
2.
Los reactivos deben chocar con la orientación adecuada para formar los productos.
3.
Las moléculas al chocar deben tener la energía mínima necesaria para lograr formar los productos. Esta energía recibe el nombre de energía de activación.


Aprende experimentando
¡diviértete en nuestro laboratorio virtual!


Te invitamos a ver
este breve video

Escanea y pon a prueba tus conocimientos.
