

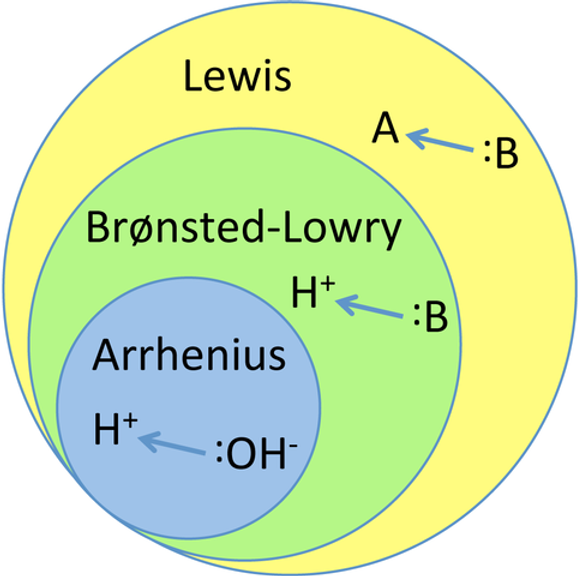
Teorías de ácidos y bases

Las teorías ácido-base son modelos científicos que explican cómo se comportan los ácidos y las bases en diferentes reacciones químicas. A lo largo del tiempo, se han propuesto varias teorías para describir mejor estos comportamientos. Las tres principales son:
1. Teoría de Arrhenius
2. Teoría de Brønsted-Lowry
3. Teoría de Lewis

Teoría de Arrhenius
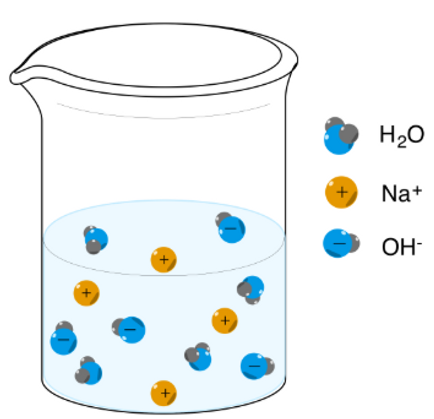
Svante Arrhenius propuso en 1884 que un ácido es una sustancia que, al disolverse en agua, produce iones hidrógeno (H⁺), y una base es una sustancia que produce iones hidroxilo (OH⁻). Esta teoría fue fundamental para entender las reacciones ácido-base como procesos de neutralización donde los iones H⁺ y OH⁻ se combinan para formar agua (H₂O).
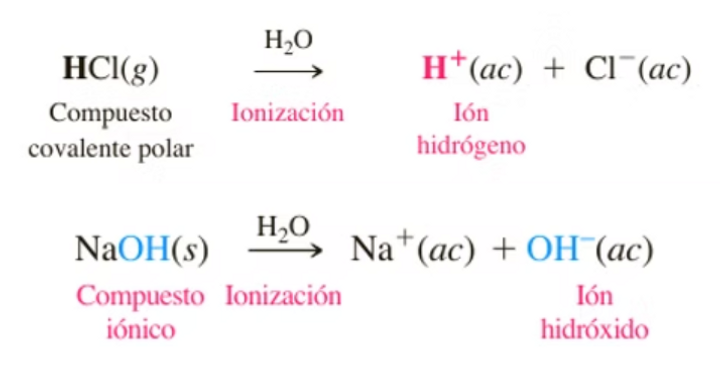

Las bases de Arrhenius
Una base de Arrhenius se define como cualquier especie que aumenta la concentración de iones hidróxido, ,en solución acuosa.
Ejemplo
Un ejemplo de una base de Arrhenius es el hidróxido de sodio ,
que es altamente soluble. El hidróxido de sodio se disocia en agua de la manera siguiente:
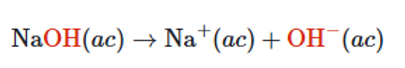
En agua, el hidróxido de sodio se disocia completamente para formar iones resultando en un incremento en la concentración de iones hidróxido.
Las bases de Arrhenius más comunes incluyen otros hidróxidos del grupo 1 y grupo 2.

Teoría de
Brønsted-Lowry
En 1923, Johannes Nicolaus Brønsted y Thomas Martin Lowry ampliaron la teoría de Arrhenius. En su teoría, un ácido es un donador de protones (H⁺) y una base es un aceptor de protones. Esta definición es más general y permite que sustancias que no necesariamente contienen hidroxilo puedan actuar como bases si pueden aceptar protones.


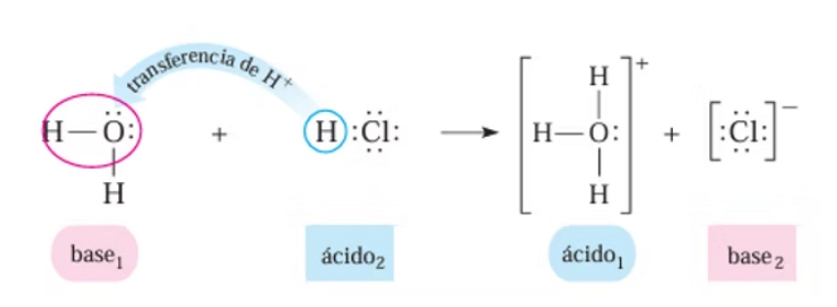
Un compuesto que dona un protón a otro compuesto se llama ácido de Brønsted-Lowry, y un compuesto que acepta un protón se llama base de Brønsted-Lowry. Una reacción ácido-base es, por tanto, la transferencia de un protón de un donante (ácido) a un aceptor (base).

El concepto de pares conjugados es útil para describir las reacciones ácido-base de Brønsted-Lowry (y también otras reacciones reversibles). Cuando un ácido dona H+, la especie que queda se llama base conjugada del ácido porque reacciona como aceptor de protones en la reacción inversa.
Cuando una base acepta H+, se convierte en su ácido conjugado. La reacción entre el agua y el amoníaco ilustra esta idea. En la reacción directa, el agua actúa como un ácido donando un protón al amoníaco y convirtiéndose posteriormente en un ion de hidróxido, OH−, la base conjugada del agua.


El amoníaco actúa como una base al aceptar este protón, convirtiéndose en un ion de amonio, NH4+, el ácido conjugado del amoníaco. En sentido inverso, un ion de hidróxido actúa como base al aceptar un protón del ion de amonio, que actúa como ácido.

Teoría de Lewis

Gilbert N. Lewis en 1923 introdujo una teoría aún más amplia. Según la teoría de Lewis, un ácido es una especie química que puede aceptar un par de electrones para formar un enlace covalente, mientras que una base es una especie que puede donar un par de electrones.
Esta teoría abarca reacciones que no implican necesariamente protones y es especialmente útil en la química de compuestos de metales de transición y en solventes no acuosos.


Conceptos clave
Ácido de Lewis
Una especie que acepta un par de electrones no enlazantes para formar un enlace covalente.
Base de Lewis
Una especie que dona un par de electrones no enlazantes para formar un enlace covalente.
Enlace covalente coordinado
Se forma cuando un átomo dona un par de electrones a otro átomo que necesita completar su octeto.
Regla del octeto
Los átomos tienden a ganar, perder o compartir electrones para lograr una configuración electrónica estable con ocho electrones en su capa de valencia.
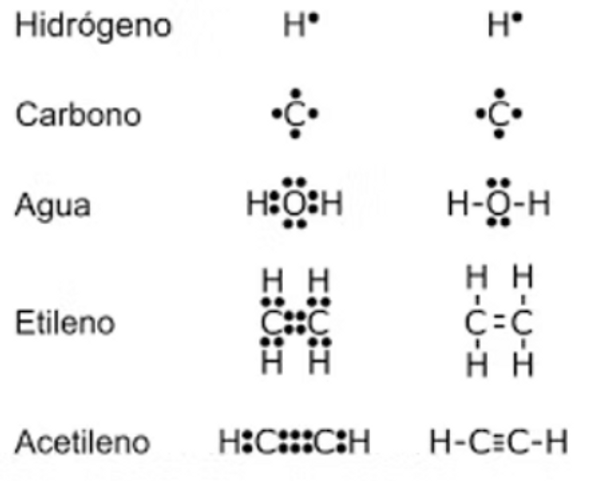
Estructuras de Lewis
Las estructuras de Lewis son diagramas que muestran cómo se distribuyen los electrones de valencia (los electrones más externos) de los átomos en una molécula o ion. Estas estructuras ayudan a representar los enlaces químicos entre átomos y los pares de electrones no compartidos.




Aplicación práctica de la teoría de Lewis y la teoría ácido-base

Detergentes y jabones
Estos productos funcionan mediante la interacción de moléculas que actúan como bases de Lewis, por ejemplo, iones de hidróxido, para eliminar la suciedad y las grasas, que pueden actuar como ácidos de Lewis.
La aplicación de la teoría de Lewis y la teoría ácido-base puede observarse en la vida cotidiana.
Medicamentos
Muchos medicamentos funcionan a través de reacciones ácido-base. Es el caso de los antiácidos, que son bases de Lewis (como el hidróxido de magnesio) y neutralizan el exceso de ácido en el estómago (ácido clorhídrico), aliviando la acidez estomacal.

Cocción
La cocción de alimentos implica muchas reacciones ácido-base. Por ejemplo, el uso de bicarbonato de sodio funciona como una base de Lewis en la repostería para que los pasteles suban al liberar dióxido de carbono cuando reacciona con un ácido.
Observa el siguiente video para acceder a un resumen dinámico de los contenidos vistos

Aprende practicando

Haz clic en la imagen para comenzar.

Haz clic en la imagen para comenzar.

